Servizi - Descrizione dei servizi
Computer System Validation
Cosa si intende per Computer System Validation? E’ la documentata evidenza che il sistema soddisfi tutti i requisiti normativi ed utente richiesti, definendo gli attori coinvolti e le responsabilità specifiche di un processo aziendale farmaceutico gestito da un sistema computerizzato.
Operare in ambito farmaceutico, infatti, vuol dire seguire procedure operative standard circoscritte e regolamentate, meglio conosciute con il termine SOPs (Standard Operative Procedures). La tutela della persona e la cura della qualità del prodotto rappresentano il punto di partenza per la genesi di norme relative alla produzione di un farmaco. La validazione, fedele a questi principi, vuole documentare in maniera formale, la consistenza ed affidabilità non solo dei processi produttivi, ma anche, nello specifico, delle apparecchiature, dei sistemi e dei servizi che hanno o che possono avere un impatto diretto o potenziale sulla qualità, purezza ed efficacia dei medicinali.
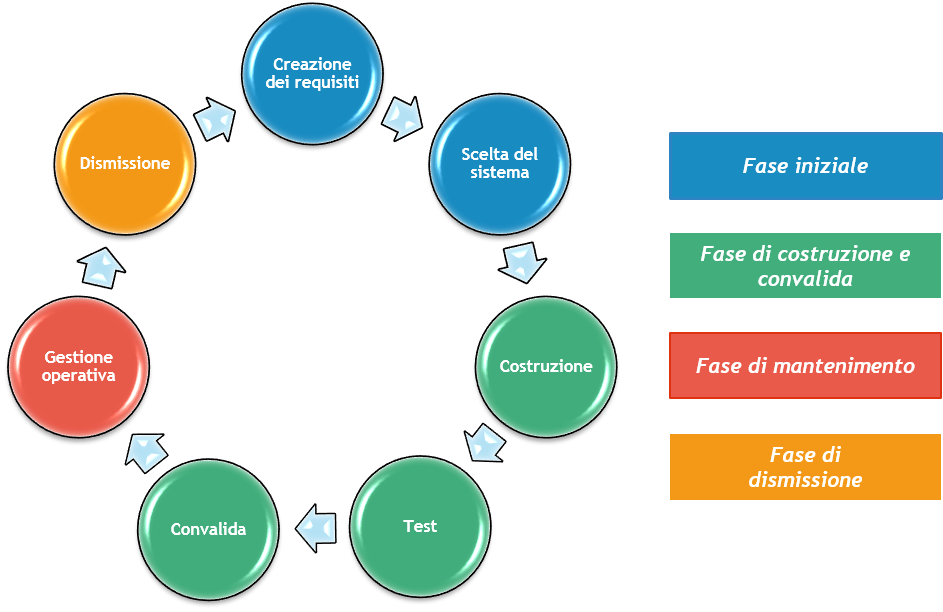
La Computer System Validation rappresenta quindi la verifica della qualifica del software e dell’hardware basata sul concetto di Ciclo di Vita e delle fasi che essa determina: la fase iniziale (creazione dei requisiti, scelta del sistema), la fase di costruzione e convalida (costruzione, test, convalida rispetto ai requisiti iniziali), la fase di mantenimento (gestione operativa) e, infine, la dismissione.
Data Integrity
La Data Integrity è il grado in cui i dati sono completi, consistenti, accurati, attendibili e affidabili e il modo in cui tutte queste caratteristiche sono mantenute per l’intero ciclo di vita del dato.
I dati devono essere raccolti e mantenuti in modo sicuro, in modo tale che possano essere attribuibili, leggibili, registrati in modo contemporaneo, originali o copie conformi, e accurati.
Assicurare la Data Integrity richiede sistemi di qualità appropriati per la gestione del rischio, comprendendo anche principi scientifici fondati e buone pratiche di documentazione.
Forniamo un approccio pianificato per la valutazione, il monitoraggio e la gestione dei dati e dei rischi a loro inerenti, con il grado di gestione commensurato all’impatto potenziale sulla salute e sicurezza del paziente e/o sull’affidabilità della decisione fatta durante tutte le fasi del ciclo di vita dei dati stessi.
IT Compliance/QA
Per l’IT Compliance/QA supportiamo e forniamo:
- conduzione di audit esterni verso i fornitori di sistemi informatici e interni da parte di enti regolatori nazionali/internazionali verso il cliente
- il Dipartimento QA del cliente per le attività di assessment sullo stato di convalida dei sistemi informatici individuando piani di remediation verso le policy di qualità e compliance
- la creazione e la revisione di Standard Operating Procedure (per la gestione informatica e/o operativa dei sistemi)
- studi di fattibilità per progetti di automazione dei processi e dei flussi (ERP, LIMS, EDMS, MES, Datawarehouse, Document Management)
- assistenza nella progettazione e nella scelta strategica (supplier selection) di infrastrutture rispondenti ai requisiti degli ambienti regolati
